¿Qué es el mieloma múltiple?
El mieloma múltiple (MM) es un tipo de cáncer de la médula ósea. La médula ósea es el tejido esponjoso presente en el centro de algunos huesos, responsable de la producción de células sanguíneas en el cuerpo.
La enfermedad se denomina mieloma múltiple porque es un cáncer que suele afectar a varias zonas del cuerpo, como la columna vertebral, el cráneo, la pelvis y las costillas.
El mieloma múltiple, la leucemia, el linfoma y el síndrome mielodisplásico son las principales causas de cáncer que afectan a las células de defensa de la sangre, llamadas leucocitos o glóbulos blancos.
Cada una de estas neoplasias, popularmente llamadas cánceres de la sangre, afecta a un tipo diferente de leucocito. En el caso del mieloma, la célula de defensa que sufre la transformación maligna es la célula plasmática (también llamada plasmocito), célula con capacidad de producir anticuerpos frente a organismos extraños a nuestro organismo, como virus, bacterias y hongos.
El mieloma múltiple representa del 1 al 2 % de todos los cánceres y del 15 al 20 % de los cánceres de la sangre. Su incidencia en la población general es de unos 7 casos por cada 100.000 habitantes. A nivel mundial, hay aproximadamente 180.000 casos y 117.000 muertes por año atribuidas a MM.
Factores de riesgo
El mieloma es una enfermedad típica de los ancianos, solo el 2% de los casos se presentan antes de los 40 años y menos del 10% antes de los 50 años. La edad promedio de los pacientes que reciben el diagnóstico es de 65 a 74 años.
El MM es más común en negros que en blancos (relación de 2:1) y más frecuente en hombres que en mujeres (relación de 1,4:1).
Otros factores de riesgo implicados en el desarrollo del mieloma son:
- Obesidad.
- Exposición a agentes químicos tóxicos como benceno, herbicidas, insecticidas, solventes orgánicos y Agente Naranja.
- Exposición a la radiación.
- Predisposición genética (antecedentes familiares de MM).
¿Cómo surge?
Lea los siguientes párrafos con calma, ya que su comprensión es esencial para comprender los síntomas y los cambios de laboratorio de la enfermedad.
Como ya se mencionó, el mieloma múltiple es un cáncer de la célula plasmática, la célula encargada de producir anticuerpos, también llamados inmunoglobulinas o gammaglobulinas.
Al igual que con otros tipos de cáncer, el mieloma surge debido a mutaciones genéticas en las células, en este caso haciendo que el cuerpo pierda el control de la producción de células plasmáticas, que comienzan a multiplicarse indefinidamente.
El resultado de esta multiplicación descontrolada es una acumulación de células plasmáticas malignas en la médula ósea, órgano responsable de la producción de todas las células sanguíneas, y la consiguiente producción excesiva de anticuerpos.
Hay cinco tipos de anticuerpos:
- IgG → Inmunoglobulina o gammaglobulina G.
- IgA → Inmunoglobulina o gammaglobulina A.
- IgM → Inmunoglobulina o gammaglobulina M.
- IgD → Inmunoglobulina o gammaglobulina D.
- IgE → Inmunoglobulina o gammaglobulina E.
Dependiendo del tipo de célula plasmática que sufra la mutación maligna, tendremos la sobreproducción del clon de uno de estos tipos de inmunoglobulina (anticuerpo). Por ejemplo, en el mieloma IgG tenemos la proliferación de células plasmáticas que producen el anticuerpo IgG, lo que se traduce en una producción excesiva de clones de inmunoglobulina G (IgG monoclonal).
El tipo más común de mieloma múltiple es el secretor de IgG, seguido, en orden descendente, por el mieloma productor de IgA e IgM. Los mielomas secretores de IgD o IgE son raros.
El mieloma secretor de IgM se denomina macroglobulinemia de Waldenström y presenta algunas características clínicas diferentes al mieloma múltiple. Hablaremos específicamente sobre la macroglobulinemia de Waldenström en un artículo separado que se escribirá en breve.
Estos clones de anticuerpos producidos en el mieloma múltiple se denominan paraproteínas o proteínas M. A través de análisis de sangre, estas paraproteínas pueden detectarse.
La existencia de proteínas M, es decir, de clones de anticuerpos, se denomina gammapatía monoclonal. Por tanto, siempre que detectamos un elevado número de anticuerpos en sangre, todos exactamente iguales (clones), nos encontramos ante una gammapatía monoclonal.
Es importante entender la diferencia entre anticuerpos monoclonales y policlonales. En casos de infecciones o procesos alérgicos, también podemos tener un aumento de anticuerpos, pero estos no son todos un solo clon, ya que son producidos por diferentes células plasmáticas. En este caso tenemos una gammapatía policlonal, que es una respuesta normal del organismo a los procesos infecciosos.
En resumen:
- El mieloma es un cáncer de las células plasmáticas, células productoras de anticuerpos.
- Las células plasmáticas enfermas se multiplican sin control y ocupan gran parte de la médula ósea.
- Las células plasmáticas enfermas producen una cantidad exagerada de anticuerpos, todos iguales, ya que proceden del mismo grupo de células plasmáticas, generando una gammapatía monoclonal.
¿Qué es la gammapatía monoclonal de significado indeterminado (MGUS)?
El mieloma múltiple casi siempre comienza como una condición relativamente benigna llamada gammapatía monoclonal de significado indeterminado (MGUS) o gammapatía monoclonal de significado incierto (GMSI).
La MGUS es una condición en la que se producen paraproteínas, pero sin ningún signo de mieloma o proliferación descontrolada de células plasmáticas en la médula ósea.
Cada año, aproximadamente 1 de cada 100 personas con MGUS desarrolla un cáncer relacionado, la mayoría de las veces, un mieloma múltiple. Sin embargo, la mayoría de las personas con MGUS nunca desarrollan cáncer ni necesitan ningún tratamiento.
Por lo tanto, el mieloma múltiple a menudo está precedido por un cuadro de gammapatía monoclonal de significado indeterminado, pero la mayoría de las personas con MGUS no progresan a mieloma múltiple.
Para ser considerado MGUS, el paciente debe tener proteínas M detectables en la sangre, pero ninguno de los síntomas de mieloma que se describen a continuación.
Síntomas del mieloma múltiple
Dolor óseo
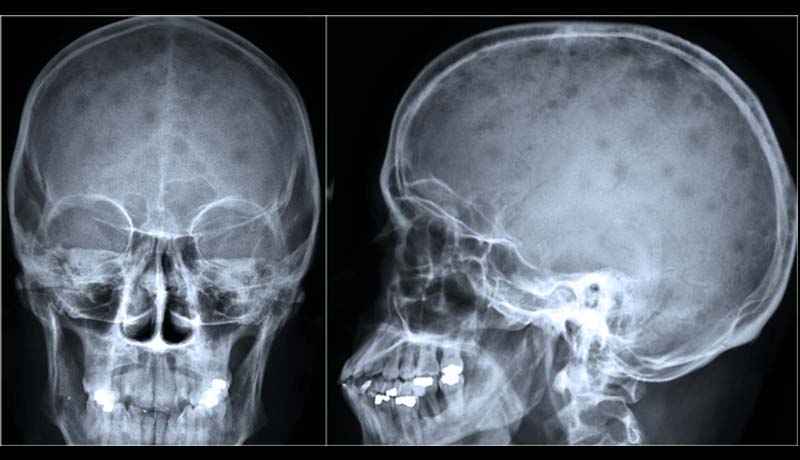
La médula ósea, encargada de producir las células de la sangre, se encuentra en el interior de los huesos. Como una de las características del mieloma múltiple es la proliferación descontrolada de células plasmáticas en la médula, una de las principales manifestaciones clínicas del mieloma es el daño óseo.
El mieloma múltiple suele afectar a varios huesos diferentes de nuestro esqueleto, especialmente a aquellos que tienen médula ósea en su interior. Los principales ejemplos son:
- Columna vertebral.
- Cráneo.
- Cadera.
- Costillas.
- Fémur (hueso del muslo).
- Húmero (hueso del brazo).
Las lesiones óseas causadas por el mieloma pueden presentarse como fracturas, que a menudo surgen espontáneamente o después de un traumatismo mínimo. También son comunes cuadros semejantes a la osteoporosis o las erosiones focales que se asemejan a las metástasis óseas de otros cánceres, conocidas como lesiones líticas.
Por lo tanto, dado que el daño óseo es tan común, el síntoma principal del mieloma suele ser el dolor óseo. Cuando la lesión afecta a las vértebras de la columna, puede haber colapso de la vértebra y compresión de la médula espinal (no confundir con la médula ósea). Como consecuencia, además del dolor lumbar, el paciente también puede experimentar debilidad y pérdida de sensibilidad en las extremidades inferiores.
Hipercalcemia
La destrucción de los huesos provoca un aumento en la liberación de calcio en la sangre. El nivel elevado de calcio en la sangre se llama hipercalcemia.
Los valores normales de calcio en sangre oscilan entre 8,5 y 10,0 mg/dL (pueden variar ligeramente según el laboratorio). Los niveles de calcio en la sangre superiores a 15 mg/dl son graves, potencialmente mortales y pueden provocar síntomas como vómitos, micción excesiva, cambios neurológicos, letargo y coma.
Lesión renal
La afectación renal, con el desarrollo de insuficiencia renal, es una de las principales manifestaciones del mieloma múltiple.
El daño renal ocurre principalmente debido al daño de los túbulos renales por inmunoglobulinas, hipercalcemia o invasión de los riñones por células plasmáticas malignas.
La principal causa de daño renal en el MM son las inmunoglobulinas monoclonales, generalmente fragmentos de estas inmunoglobulinas, llamadas cadenas ligeras.
En situaciones normales, las cadenas ligeras existentes se filtran libremente a través del glomérulo renal y las células tubulares las reabsorben en gran medida de vuelta a la sangre. Sin embargo, en los casos de mieloma, la producción de inmunoglobulinas y cadenas ligeras es tan alta que supera la capacidad de reabsorción de los túbulos, lo que se traduce en una gran pérdida de inmunoglobulinas y cadenas ligeras en la orina.
El exceso de cadenas ligeras en los túbulos se une a una proteína llamada uromodulina (anteriormente llamada mucoproteína de Tamm-Horsfall). Esta unión hace que las cadenas ligeras formen cilindros dentro de los túbulos, provocando obstrucción, reacción inflamatoria y destrucción de los túbulos renales y de los tejidos circundantes. Este daño renal se conoce como riñón de mieloma.
Alrededor del 20 al 50 % de los pacientes con mieloma múltiple tienen niveles elevados de creatinina en el momento del diagnóstico (lea: Creatinina y urea: qué son y valores normales), lo que indica daño renal.
El grado de insuficiencia renal varía desde un daño leve que puede revertirse rápidamente, como en los casos de deshidratación o hipercalcemia, hasta una lesión renal aguda grave que requiere tratamiento con hemodiálisis.
Anemia
Otra complicación común del mieloma múltiple es la anemia. Con la médula ósea completamente invadida por células plasmáticas, se produce una reducción progresiva en la producción de otras líneas de células sanguíneas, como los eritrocitos (glóbulos rojos), lo que acaba provocando anemia.
Siguiendo el mismo razonamiento, también podemos tener un descenso en las concentraciones de plaquetas y leucocitos (glóbulos blancos).
Infecciones
Aunque hay un elevado número de anticuerpos circulantes, en la gammapatía monoclonal estos anticuerpos son defectuosos. El organismo pierde la capacidad de crear anticuerpos específicos contra cada invasor y mantiene la producción de un solo clon de inmunoglobulina.
Por tanto, a pesar de tener exceso de anticuerpos circulantes en la sangre, el paciente con mieloma múltiple es un individuo más susceptible a las infecciones.
En resumen, el cuadro clínico típico del mieloma es:
- Paciente mayor de 65 años.
- Dolor óseo, generalmente en la parte baja de la espalda.
- Aumento en el nivel de calcio en la sangre.
- Anemia sin causa aparente.
- Cambios en el funcionamiento de los riñones.
Obviamente, el paciente no necesita tener todos los síntomas enumerados anteriormente al mismo tiempo, especialmente en las primeras etapas de la enfermedad. Sin embargo, a medida que avanza el mieloma, el cuadro clínico típico se vuelve común.
Diagnóstico
A través de análisis específicos de sangre y orina, es posible identificar la presencia de clones de anticuerpos. Esta investigación se realiza mediante una prueba llamada electroforesis de proteínas con inmunofijación.
Algunos marcadores sanguíneos también suelen estar elevados en el mieloma múltiple, como VSG (velocidad de sedimentación globular), LDH y Beta 2-microglobulina. Es importante tener en cuenta que estos análisis de sangre no son específicos y pueden estar alterados en varias enfermedades, además del mieloma.
La medición de la creatinina en sangre también es útil, ya que ayuda a identificar el daño renal.
Las radiografías de cadera, columna vertebral, cráneo y tórax pueden detectar lesiones óseas en el mieloma y, a menudo, forman parte del proceso de diagnóstico. En lugares con buena disponibilidad de recursos médicos, la evaluación del esqueleto se puede hacerse con tomografía computarizada, resonancia magnética o PET/TC (tomografía por emisión de positrones).
Biopsia de médula ósea
Si las pruebas anteriores sugieren la existencia de mieloma, el paciente debe ser remitido a un hematólogo para que realice una aspiración y biopsia de médula ósea, que son las pruebas que proporcionan el diagnóstico definitivo de mieloma.
Si la biopsia muestra que más del 10 % de las células de la médula están compuestas por células plasmáticas, se confirma el diagnóstico de mieloma múltiple.
Tratamiento
No hay cura para el mieloma múltiple. El objetivo del tratamiento es aliviar los síntomas, mejorar la calidad de vida y aumentar el tiempo de supervivencia.
Hay varias modalidades de tratamiento. El esquema más adecuado suele decidirse en función de dos factores:
- Gravedad de la enfermedad.
- Elegibilidad para el trasplante autólogo de células madre hematopoyéticas.
Criterios de severidad
Al efectuar una biopsia de médula ósea, un médico puede ordenar una prueba llamada hibridación fluorescente in situ (FISH), que es una técnica citogenética utilizada para detectar y localizar la presencia de ciertas secuencias de ADN en los cromosomas de las células cancerosas.
Aquí no caben explicaciones complejas sobre las técnicas de este examen o sobre la genética del mieloma. Para los pacientes, la información importante es que la identificación de ciertas anomalías cromosómicas en las células neoplásicas se relacionan con un cuadro más grave de mieloma múltiple. Son ellas:
- t(4;14).
- t(14;16).
- t(14;20).
- del17p13.
- Ganancia de 1q.
Los valores elevados de LDH y Beta 2-microglobulina y los valores bajos de albúmina también se utilizan comúnmente en la estratificación de riesgo de MM.
Los pacientes con los hallazgos anteriores se clasifican como de alto riesgo, tienen menor supervivencia y peor respuesta a los tratamientos convencionales.
Trasplante autólogo de células madre hematopoyéticas
Después del diagnóstico y de la estratificación del riesgo, se debe evaluar a todos los pacientes con mieloma para determinar la elegibilidad para el trasplante autólogo de células madre hematopoyéticas (TCMH).
La elegibilidad para TCMH autólogo en mieloma varía entre países e instituciones. En la mayoría de los países, el trasplante de MM se ofrece a pacientes menores de 65 años. Los pacientes menores de 75 años también pueden ser candidatos según su estado clínico.
El TCMH autólogo se basa en el hecho de que todas las células maduras que circulan en la sangre se originan a partir de una sola célula, denominada célula madre.
El trasplante autólogo de células madre hematopoyéticas consiste en extraer las propias células madre del paciente y almacenarlas. Antes de recibir nuevamente las células madre, el paciente recibe dosis de quimioterapia, generalmente con melfalán, para minimizar la cantidad y producción de células plasmáticas neoplásicas en la médula ósea. Este proceso de “limpieza” de la médula ósea se llama acondicionamiento.
Una vez que se realiza el acondicionamiento, las células madre almacenadas se infunden en la sangre del paciente. Las células madre infundidas viajan naturalmente a la médula ósea, donde dan lugar a una nueva población de células sanguíneas sanas.
En comparación con la quimioterapia sola, el TCMH autólogo parece prolongar la supervivencia general y sin complicaciones.
La recolección de células madre debe realizarse al principio del curso del tratamiento para todos los pacientes elegibles, independientemente de si el plan es incorporar el TCMH en el tratamiento inicial o aplazarlo hasta el momento de la primera recaída.
Regímenes más indicados
Los pacientes elegibles para un trasplante autólogo de células madre hematopoyéticas generalmente se someten a 4 ciclos (4 meses) de quimioterapia con daratumumab, bortezomib, lenalidomida y dosis bajas de dexametasona antes de la recolección de células madre. Este tratamiento tiene como objetivo reducir el número de células tumorales en la médula ósea y sangre periférica, disminuir los síntomas y mitigar el daño a los órganos diana.
En algunos casos, la producción de inmunoglobulinas es tan intensa que la sangre se espesa. En este caso, antes de la quimioterapia, es necesario realizar sesiones de plasmaféresis, un procedimiento similar a la hemodiálisis, que reduce la concentración de células en el plasma.
Después de 4 meses, el paciente puede elegir entre continuar con el tratamiento de quimioterapia hasta por 1 año y reservar el trasplante solo en caso de recidiva o efectuar el trasplante de forma anticipada.
Si se opta por el TCMH autólogo temprano, el paciente después del procedimiento mantiene otros dos años de quimioterapia con bortezomib.
En pacientes no elegibles para TCMH, el tratamiento suele ser con bortezomib, lenalidomida y dosis bajas de dexametasona durante 8 a 12 meses, seguido de tratamiento de mantenimiento con bortezomib.
Pronóstico
La supervivencia de los pacientes con mieloma es, en promedio, de 5 años para los casos detectados inicialmente y de 2 años para los casos más avanzados.
Dependiendo de la respuesta al tratamiento, el pronóstico puede ser mejor o peor.
- Respuesta completa estricta (25% de los casos): mediana de supervivencia superior a 5 años y el 80% de los pacientes seguirán vivos después de 5 años.
- Respuesta completa (8% de los casos): mediana de supervivencia de 81 meses y el 53% de los pacientes seguirán vivos después de cinco años.
- Respuesta casi completa (20% de los casos): mediana de supervivencia de 60 meses y el 47% de los pacientes seguirán vivos después de cinco años.
- Respuesta parcial (25% de los casos): mediana de supervivencia de 59 meses.
- Enfermedad estable (5% de los casos): mediana de supervivencia de 56 meses.
- Enfermedad progresiva (4% de los casos): mediana de supervivencia de 9 meses.
Referencias
- Multiple myeloma: Clinical features, laboratory manifestations, and diagnosis – UpToDate.
- Multiple myeloma: Overview of management – UpToDate.
- Multiple myeloma: Pathobiology – UpToDate.
- Multiple myeloma: Staging and prognostic studies – UpToDate.
- Multiple Myeloma – Medscape.
- What Is Multiple Myeloma? – American Cancer Society.
- Kaushansky K, et al., eds. Myeloma. In: Williams Hematology. 9th ed. New York, N.Y.: McGraw-Hill Education; 2016.
- Goldman L, et al., eds. Plasma cell disorders. In: Goldman-Cecil Medicine. 25th ed. Philadelphia, Pa.: Saunders Elsevier; 2016
Autor(es)
Médico licenciado por la Universidad Federal de Río de Janeiro (UFRJ), con títulos de especialista en Medicina Interna por la Universidad Federal de Río de Janeiro (UFRJ) y de Nefrología por la Universidad Estadual de Río de Janeiro (UERJ) y por la Sociedad Brasileña de Nefrología (SBN). Actualmente vive en Lisboa, Portugal, tiene títulos reconocidos por la Universidad de Oporto y por el Colegio de Nefrología de Portugal.





Leave a Comment